�w�p�R����
��b����w�ԏp�O�`�p��܂ł̎�p�̗���
- �����_�H��w �b��O�Ȋw����
�y�����@���� ����
�y��p�t���[�z
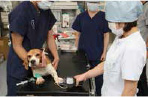
�ǂ�Ȏ�p�ɂ����Ă��A���{�ƂȂ��Z�Ɋւ����A�̗���͓������̂ƌ�����B�܂��A�����̊�{�I�Ȏ�Z�̐ςݏd�˂����ɏd�v�ł���B����̓��W�L���̓��e�́A�M�҂��������H���Ă�����̂ł���A�����܂ł����ł���B����Ė{���W�L�����Q�l�ɂ��āA�F�l�Ȃ�ɃA�����W���Ă������������B��p�Ɋւ��X���A�����ӎ��������Ă���������K���ł���B
�y7�z�p�O�S�g��Ԃ̃`�F�b�N
�����O�̃`�F�b�N�ɊO���Ȃ���\�I�ȂR���ڂ��������
�p�O���t�����w�����A�����g�Q���A�S�G�R�[�����ɂ��Ă͑������Q�l�ɂ��邱��
���̉��i�������j�F�����m�̕��������Ǝv�����A���K�̂��ߐ�������
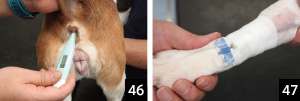
1.�̉��v�������A���E�L�̔��������A���ɑ̉��v������B
���̏ꍇ�́A�O�A
���ƊԈႦ�Ȃ��悤�ɂ����i�ʐ^46�j�B
2.�̉��v����ꂽ������~�낵�A�����������b�N�X��������Ԃő��肷���i�ʐ^47�j�B
| �� | �L | |
|---|---|---|
| �̉��i���j | 38.0�`39.0 | 38.0�`39.5 |
�������܂ŎQ�l�l�Ƃ��ĔF�����Ă������������B�q���⋻�����ɂ͑̉��������ȂǁA�ɂ��ω����邱�Ƃ��F�����Ă������ƁB
�̉��v�����ɓ����ۂɁA�����������ē������芚�肷�邱�Ƃ�����B�ے�҂͊��܂ꂽ��A�����������o���Ȃ��悤�C������B�������A���u���鑤�̑o���ɁA�Q���Ȃ��悤�S�����邱�Ƃ���ł���B
�֘A���i
���S�d�}�F�S�����̔c���ƕs�����̔�����]���Ӌ`�Ƃ���
�l�X�ȓd�Ƀ��[�h�̂����A����̓��j���N���b�v�d�Ƀ��[�h�ł̐S�d�}����ɂ��Đ�������
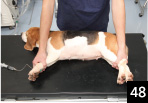
1.�S�d�v���̃A�[�X���Ƃ��Ă��鎖���m�F��A�E������ʂŕے肷��B�S�����}�b�g�̕~���ꂽ�������Ȃǂōs���Ɛ��m�Ȍ��ʂ��ł₷���i�ʐ^48�j�B
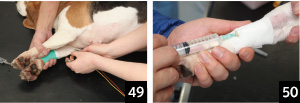
2.�O���͕I�t�߁A�㎈�͕G�t�߂��A���R�[���A�d�ɗp�N���[���A���邢�͐����H�������ŔG�炵�A�d�ɂ������i�ʐ^49�A50�j�B
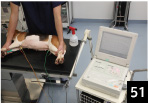
3.�����𗎂��������A�g�`�����肵����L�^���J�n����B�ʏ�̐ݒ�́A�y�[�p�[����̑�����50mm/sec ���x��1mV=1cm �Ƃ��������ǂ��i�ʐ^51�j�B
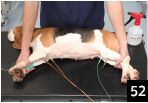
4.�ʏ�d�ɂ͈ȉ��̈ʒu�ɑ����i�ʐ^52�j�B
�ԐF�@�E�O���@�i�}�C�i�X�d�Ɂj
���F�@���O���@�i�}�C�i�X���邢�̓v���X�d�Ɂj
���F�@�E�㎈�@�i�������A�[�X�j
�ΐF�@���㎈�@�i�v���X�d�Ɂj
�E��p���̕s�����̔����ɂ́A�����_�o�o�����X��S�؋������傫���֗^���Ă���B�܂��A�����̊W��A�����������ɂ��łɕs�����������邱�Ƃ�����A�p�O�ɐS�d�}�g�`���L�^���Ă����ׂ��ł���B
�E�d�Ƀ��[�h�͕t���ԈႦ��ƖړI�̗U����I���ł��Ȃ����Ƃ�����̂ŁA�g�p�O�Ƀv���X�ƃ}�C�i�X�̓d�Ƀ��[�h��c�����Ă����B�ʏ��QRS �Q����ԑ傫��������U�U���i�{ 60���̕��ϓd�C���j��I�����邱�Ƃ������B
�E�ċz�E�z��Ԃ��s����ȏꍇ�A����◧�ʂ��������邪�A�A�[�`�t�@�N�g�������₷�����Ƃ��l������B
�������F�܂��܂����肳���搶�͏��Ȃ����A����x�d�v����F�����Ă�����������
����͓����p����������p������ό��I��������@�̈����������
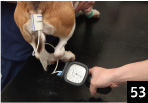
1.���蕔�̎��͒�30�`40�����̓K�ȃJ�t��I��ő���ʒu�ɐݒu����B�����āA�J�t��t�����܂b�����̏�ԂɊ��ꂳ����i5 ���ȏ�j�B
2.����̈ʂ͉\�Ȍ��薳�ے肪�]�܂����A�J�t�ƐS���̈ʒu�����������ɂȂ�
�悤�ɂ����i�ʐ^53�j�B
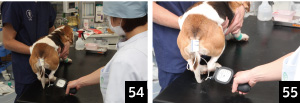
3.��ϓI�ɗ����������Ɣ��f�����猌��������J�n����B���蒆�ɐS���������X�ɒቺ�����肷�錻�ۂ��F�߂����i�ʐ^54�j�B
4.�Œ�3 �` 5 ��͑��肵�A����l�̕ϓ���5mmHg �ȓ��ł�����̂�3����܂ŌJ��Ԃ��i�ʐ^55�j
�|�C���g4�F�O�r���̎荪�߂ł̑���
�E�������蕔�ʂƂ��ẮA�O�r���̎荪�ߏ㕔�A���ڕ��̑����ߏ㕔�A�����������Ƃ��ċ�������B���ے�ł�����\�A�̓��̉e�������Ȃ��A�J�t�������e�ՂȂǂ̓_����A���������ł͔������ł̑��肪�L�p�ł���B�i�ʐ^�|�C���g4�j
�E�������ْ����邱�Ƃ�����邽�߁A���^�����L�ł̓L�����[���ő��肷��ȂǁA�����������b�N�X�������Ԃݏo���H�v�����Ă������������B
| ������ | ���k������ �immHg�j |
���ό��� �immHg�j |
�g�������� �immHg�j |
|---|---|---|---|
| �� | 144�}27 | 110�}21 | 91�}20 |
| �L | 139�}27 | 99�}27 | 77�}25 |
�֘A���i
�y8�z�����E�}��
�e����@�\�ɑ傫�Ȗ�肪�Ȃ��ꍇ�̈����������@�����ʂ͎Q�l�l�ł���A���@�͂��ꂼ��̕a�@�̂����ɏ����邱��
�y�������Ă������́z
�p�ӂ��Ă��������֘A��A�A�����A�C�ǃ`���[�u�A�o�C�g�u���b�N���̓`���[�u�^�C�A�����}�X�N�A�K�[�[�A�T�[�W�J���e�[�v�i�ׂ����́j�A�V�����W�i�C�ǃ`���[�u�J�t�p�j�A�L�V���J�C���[���[
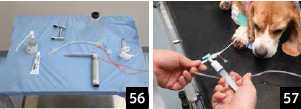
1.�}�ǂɕK�v�Ȋ������������i�ʐ^56�j�B
2.�O���������J���A�����֘A��̓������V�����W������B�A���Ȃŏ��ł���ȂǑS�H���ۓI�ɍs�������i�ʐ^57�j�B
���������^���@��
�E���_�A�g���s���i0.05mg/kg SC�j, �A���s�V����or �Z�t�@�]�����i25mg/kg IV�j�𓊗^���A5 ���ԑ҂B
�E��Ύ_�u�g���t�@�m�[���i0.2mg/kg IV�j�A�~�_�]�����i0.2mg/kg IV�j�𓊗^���A5 ���ԑ҂B
�E�v���|�t�H�[��6mg/kg
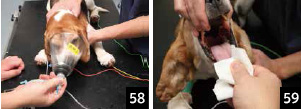
3.�ʂ�p�ӂ��A���҂̗l�q�����A���^�ʂ��������Ȃ���30�b�ȏォ���Ă�����蓊�^����B�قƂ�ǂ̊��҂ł́A�����O���^��̌��ʂɂ��v���|�t�H�[�������^�ʂ�2 �` 3mg/kg�ւƗ}�����邪�A���{�̒o�ɂ�����Ȃ��Ȃǂ̏ꍇ�́A�K�v�ɉ����ċz���������s���i�ʐ^58�j�B
4.�����̉��{���o�ɂ�����K�[�[�Ő�����B�����Ĕ��̎�ŏ�{�̑��O�P���ӂ�������A�f���������J���i�ʐ^59�j�B
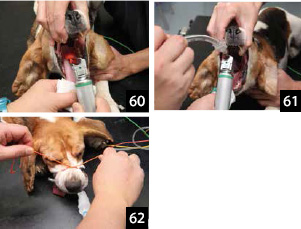
���`���[�u�^�C���g�p�������@
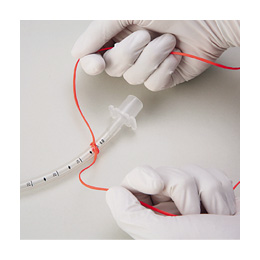
5.�b��t�͍A������p���A���W���m�F���i�ʐ^60�j�A�C�ǂ������Ȃ��悤�ɋC�ǃ`���[�u��}�ǂ����i�ʐ^61�j�B
�}�ǂ�����A�C�ǃ`���[�u���g���j�e�B�g���C�N�`���[�u�^�C�œ����̊{����
�Œ肷���i�ʐ^62�j�B

6.�C�ǃ`���[�u��l�H�ċz��ɂȂ��A�l�H�ċz���J�n�������i�ʐ^63�j�B
���j�^�[�J�v�m�O�����ɂ��CO2�g�`���m�F���A�C�Ǔ��ɑ}�ǂ���Ă��邩�m�F����B
���������C�ǃ`���[�u�̃J�t�����C�����āA���[�N�̏������m�F�����i�ʐ^64�j�B
�E�����������n�܂�Ɠ����͎����ċz����~���邽�߁A���̏��u���̃~�X�͋�����Ȃ��B���̂��ߎ�p�ɗՂޑS������A�̗���ɓ���A�v�������m�ɍs���K�v������B
�E�C�ǃ`���[�u�ɂ͎��O�ɃL�V���J�C���[���[�����ď������Ă����ƁA�}�ǂ��X���[�Y�ɍs����B
�E �����J���߂���ƍA�����L�W���Ă��܂��A�C�ǂ������Ȃ��Ă��܂��B���̂��ߗ��K���d�˂āA�}�ǎ҂���݂Đ��傪���ʂɊm�F�ł���悤�Ɋ���Ă������ƁB
�E�C�ǃ`���[�u���H���ɓ������ꍇ�A���j�^�[�J�v�m�O������CO2 ���[���ɋ߂��Ȃ�̂ŁA���j�^�[�ɂ͏�ɒ��ӂ���B
�E�l�H�ċz��̃\�[�_���C���̌����ɂ����ӂ���B�S�̂��ϐF����O�Ɍ������Ă������ƁB
�E ���ߌċz�͏ɍ��킹�ĕω������邪�A�ʏ�8�`15 �� / ���A�C��������10 �` 15cmH2O �ɐݒ肷��Ɨǂ��B
�֘A���i
�y9�z �p��̒�сE����
��p�̉������̊����̏p��ɂ��Đ�������
�y�������Ă������́z
�o���J�����̓T�[�W�J���N���b�p�[�A�ŋۖȁA���[�h�n���ō܁i�|�s�h�����[�h���j�A���ŗp�A���R�[���A�n�C�|�G�^�m�[���i���[�h�E�F�p�j�A�N�����w�L�V�W���A�O���[�u�A�X�v���[
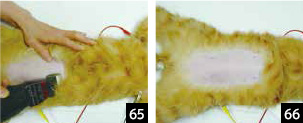
1.���҂���ʂɕے肵�āA��p��ɌŒ肷��B�o���J���i0.1mm�������߁j��p���A�؊J���ʂ𒆐S�ɒ��J�ɒ����`�ɒ�т��s���i�ʐ^65�A66�j�B
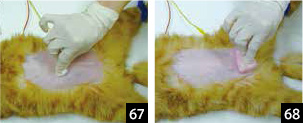
2.�q�r�X�N���u��p���āA�؊J������O�Ɍ�����l�ɐ����s���B���̍ہA����Əp��ׂ̍����т𗎂Ƃ��ړI�Ȃ̂ŁA�O���[�u�����Ă������艘��𗎂Ƃ��i�ʐ^67�A68�j�B
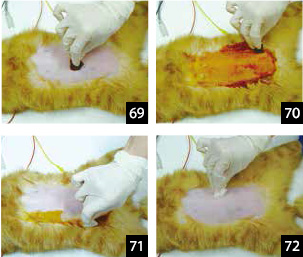
3.���������C�\�W����p���ď��ł��s���B���̍�ƂŒ��S����O��������l�ɏ��ł��s���i��
�^69�A70�j�B
�C�\�W�����n�C�|�G�^�m�[�����Y��ɒE�F���A�c�����@������i�ʐ^71�j�B
4.�Ō�ɃA���R�[���ōŌ�̏��ł��s���B�p��ɉ���A�тȂǂ̎c�������Ȃ��l�ɏ\���ɋC�������i�ʐ^72�j�B
�E�o���J���̐n��0.1mm�̕����g���ƍׂ�����т��ł���B
�E��т͈̔͂͊��҂̑傫���ɂ���邪�A�\�肵�Ă���p����1�`2cm���x�]���ɒ�т���ƁA�L���p����m�ۂł���B
�E�䓁�͏p��ɏ������������A�s�K�v�Ȋ������X�N�����߂�̂ŁA�g�p���Ȃ��ق��������ł��낤�B
�E�C�\�W���ɂ͎c�����ʂ�����A�h�z������ɖ�3���Òu����ƎE�ی��ʂ����������B
�E���Ŗ�ɑ��ăA�����M�[�����������̂����邱�Ƃɒ��ӂ��邱�ƁB